IPTG (isopropil-β-D-tiogalactósido) es un análogo del sustrato de β-galactosidasa, que es altamente inducible.Bajo la inducción de IPTG, el inductor puede formar un complejo con la proteína represora, de modo que la conformación de la proteína represora cambie, de modo que no pueda combinarse con el gen diana y el gen diana se exprese de manera eficiente.Entonces, ¿cómo se debe determinar la concentración de IPTG durante el experimento?¿Cuanto más grande, mejor?
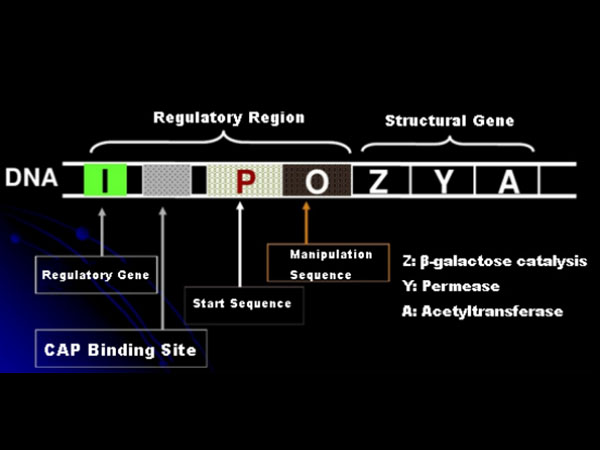
Primero, comprendamos el principio de inducción de IPTG: el operón (elemento) lactosa de E. coli contiene tres genes estructurales, Z, Y y A, que codifican la β-galactosidasa, la permeasa y la acetiltransferasa, respectivamente.lacZ hidroliza la lactosa en glucosa y galactosa, o en alolactosa;lacY permite que la lactosa del medio ambiente atraviese la membrana celular y entre en la célula;lacA transfiere el grupo acetilo del acetil-CoA al β-galactósido, lo que implica eliminar el efecto tóxico.Además, hay una secuencia operativa O, una secuencia inicial P y un gen regulador I. El código del gen I es una proteína represora que puede unirse a la posición O de la secuencia operadora, de modo que el operón (meta) queda reprimido y apagado.También hay un sitio de unión para el sitio de unión de la proteína activadora del gen catabólico-CAP aguas arriba de la secuencia iniciadora P. La secuencia P, la secuencia O y el sitio de unión de CAP constituyen juntos la región reguladora del operón lac.Los genes codificantes de las tres enzimas están regulados por la misma región reguladora para lograr la expresión coordinada de los productos genéticos.
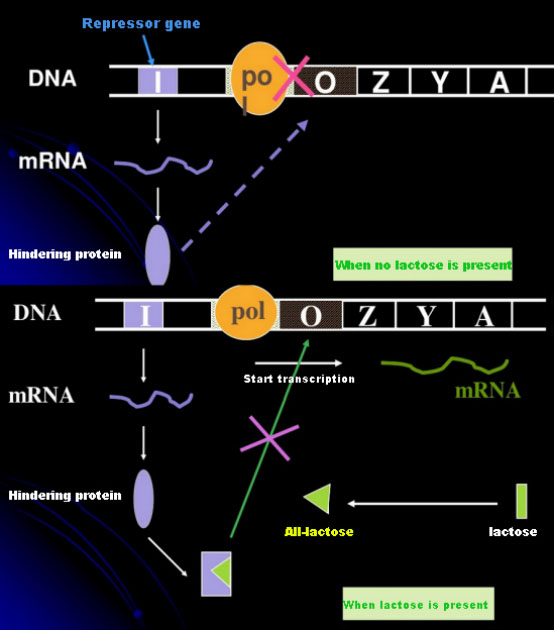
En ausencia de lactosa, el operón lac (meta) se encuentra en estado de represión.En este momento, el represor lac expresado por la secuencia I bajo el control de la secuencia promotora PI se une a la secuencia O, lo que evita que la ARN polimerasa se una a la secuencia P e inhibe el inicio de la transcripción;cuando hay lactosa presente, se puede inducir el operón lac (meta). En este sistema de operón (meta), el verdadero inductor no es la lactosa en sí.La lactosa ingresa a la célula y es catalizada por la β-galactosidasa para convertirse en alolactosa.Esta última, como molécula inductora, se une a la proteína represora y cambia la conformación de la proteína, lo que conduce a la disociación de la proteína represora de la secuencia O y la transcripción.El isopropiltiogalactósido (IPTG) tiene el mismo efecto que la alolactosa.Es un inductor muy potente, que no es metabolizado por bacterias y es muy estable, por lo que es muy utilizado en laboratorios.
¿Cómo determinar la concentración óptima de IPTG?Tomemos como ejemplo la E. coli.
La cepa de E. coli BL21 modificada genéticamente que contenía pGEX recombinante positivo (CGRP/msCT) se inoculó en medio líquido LB que contenía 50 μg·ml-1 Amp y se cultivó durante la noche a 37 °C.El cultivo anterior se inoculó en 10 botellas de 50 ml de medio líquido LB fresco que contenía 50 μg·mL-1 Amp en una proporción de 1:100 para el cultivo de expansión, y cuando el valor de OD600 fue de 0,6~0,8, se añadió IPTG a la concentración final.Es 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0 mmol·L-1.Después de la inducción a la misma temperatura y al mismo tiempo, se tomó 1 ml de la solución bacteriana y las células bacterianas se recogieron por centrifugación y se sometieron a SDS-PAGE para analizar la influencia de diferentes concentraciones de IPTG en la expresión de proteínas, y luego seleccione la concentración de IPTG con la mayor expresión de proteínas.
Después de los experimentos, se encontrará que la concentración de IPTG no es tan grande como sea posible.Esto se debe a que IPTG tiene cierta toxicidad para las bacterias.Exceder la concentración también matará la célula;y en términos generales, esperamos que cuanto más proteína soluble se exprese en la célula, mejor, pero en muchos casos, cuando la concentración de IPTG es demasiado alta, se formará una gran cantidad de inclusión.Cuerpo, pero la cantidad de proteína soluble disminuyó.Por lo tanto, la concentración de IPTG más adecuada a menudo no es cuanto mayor sea mejor, sino cuanto menor sea la concentración.
El propósito de la inducción y el cultivo de cepas genéticamente modificadas es aumentar el rendimiento de la proteína objetivo y reducir los costos.La expresión del gen diana no sólo se ve afectada por los factores propios de la cepa y el plásmido de expresión, sino también por otras condiciones externas, como la concentración del inductor, la temperatura de inducción y el tiempo de inducción.Por lo tanto, en general, antes de expresar y purificar una proteína desconocida, es mejor estudiar el tiempo de inducción, la temperatura y la concentración de IPTG para seleccionar las condiciones adecuadas y obtener los mejores resultados experimentales.
Hora de publicación: 31-dic-2021

